試験が近いこともあって質問に来る学生も増えてきました。
で、SN1反応では、 そもそも試薬が存在しなくなるのではという質問がありましたので、その回答を紹介します。(高口加筆>第3Qの講義「反応速度論」でスッキリ理解できるようになるはずです。)
教科書に載っているように、SN1反応の反応速度式(反応速度=k[RY])は、ハロゲン化アルキルの濃度に依存する1次反応です。
だから、試薬自身の濃度が最も濃い、ハロゲン化アルキルの原液のような状態(試薬瓶の中)では、
1分子反応で、試薬自身が分解されてしまい、そもそも有機化学反応には使えないのではないか?
律速段階で結合を切るエネルギーはどこから得ているのか?という疑問です。
確かに、反応速度式だけを見ると、誤解をしてしまいがちです。
まず、SN1反応のエネルギーの図を書いて、反応の全貌をもう一度考えてみましょう。
SN1反応は、活性中間体を経る触媒反応などと一緒で、カルボカチオン中間体を通るために、反応はSN2反応よりも速くなり、速度式も変わりますが、そもそも基質が揃わないと、反応は進行しません。
なぜ、こういう速度式になるかは、律速段階で反応速度が決まるからなのですが、
1)カルボカチオン中間体は不安定
(カルボカチオンのエネルギーが高く、ハロゲン化アルキルのエネルギーは低いので、アップヒルで不利な反応である)
2)カルボカチオン中間体生成反応は可逆な平衡反応であり、その平衡は、圧倒的に原系に偏っている
3)原料だけであれば、たとえ、結合が切れたとしても、逆反応が進行して元に戻る。
したがって、分子が試薬瓶の中でどんどん分解していくことはありません。
さらに、ここには、有機反応をする場所、すなわち「溶媒」の効果も隠れています。
溶媒分子はSN1反応の際、
1)ハロゲン化アルキルと衝突しまくっていて、ハロゲン化アルキルにエネルギーを与える。
2)カルボカチオンと溶媒和し、カルボカチオンを安定化させる。
3)X–が溶媒和し安定化されることで、X–の脱離を促進させる。
という3つの役割をしています。
では、どうして、このような複雑な要素が入っているSN1反応の反応速度がk[RY]と単純な形になるのか?
ここの部分はとっても面白いところなのですが、本質的な理解は、第3Qの講義「反応速度論」にお任せをします。
補足)
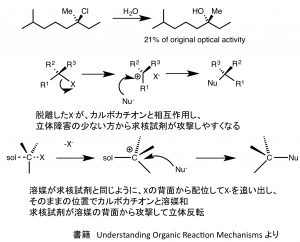
カルボカチオンは溶媒和されて安定化されたり、脱離したX–と弱く相互作用したりしていますので、実際には教科書に書かれているような立体の反転を伴った「部分ラセミ化」にとどまります。下の図をみるとわかりやすいかと思います。