ホウ素中性子捕捉療法(BNCT:Boron Neutron Capture Therapy)はがん選択的な傷害を可能とする有効な治療法です。BNCTでは、がん細胞のみにホウ素薬剤を取り込ませた後、エネルギーの低い中性子線を照射し、がん細胞内で「核反応」を起こさせます(式1)。
10B + 1n → 7Li + 4He + 2.4 MeV (式1)
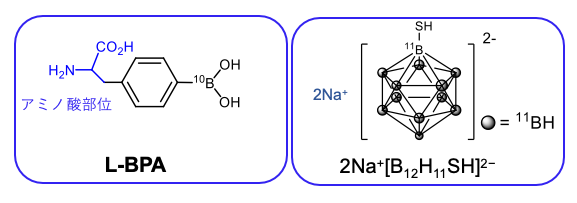
中性子線照射の際に発生した2つの粒子(α線とLi原子核)は2 .4 MeVという細胞1つを殺傷するのに十分なエネルギーをもち、がん細胞を殺傷することができます。中性子照射によって発生したα粒子とLi原子核の飛距離は4~9 μm で、この飛距離は細胞1個の直径よりも小さいため、がん細胞のみにホウ素薬剤が取り込まれていれば、隣の正常細胞を損傷することなく、がん細胞のみを死滅させることが可能です。そのため、がん細胞と正常細胞が混在している悪性度の高いがんに効果的で、患者さんの生活の質(QOL)が高い治療法であるとも考えられています。しかし、ホウ素薬剤として利用可能な医薬品は2020 年から薬事承認されているアミノ酸にホウ素ユニットを化学修飾したホウ素製剤 p-borono-L-phenylalanine (L-BPA)のみです(Figure 1)。L-BPAは、頭頚部がんや悪性脳腫瘍、皮膚悪性腫瘍などで素晴らしい成果を示しており、非常に優秀なホウ素薬剤です。しかし、L-BPA の取り込みが低いがんもあり、さまざまながんへ対応するためにL-BPA以外のホウ素薬剤が強く望まれています。L-BPA以外に注目されているホウ素薬剤としてメルカプトウンデカヒドロドデカボラート(BSH:[B12H12SH]2-)が第2のホウ素薬剤の候補としてあげられています(Figure 1)。近年、化学修飾やホストゲストを使ってがん細胞への選択性や細胞に蓄積に関する成功例が報告されていますが、生体イメージングの確立がされていないことが問題となっており、L-BPA につぐ、第2、第3のホウ素製剤がないのが現状です。
補足1)日本は唯一の被爆国ですので、「核反応」と聞くと恐ろしい反応をイメージされる方もいるのではと思います。説明が正しいかはわかりませんが、発生する7Li と4Heも安定同位体で放射性同位体ではないため、原子爆弾のように大量の放射性同位体を生成することがない上に、発生したエネルギーはがん細胞1つだけを選択的に破壊するが、隣の正常細胞には大きな影響を及ばさないため、核爆発が起きているイメージとは遠いと思われます。実は、核反応で生じる放射線を適切に使えば人を救う力もあることは既に知られており、医療現場では、PET(Positron Emission Tomography:陽電子放射断層撮影)イメージングやヨウ素による甲状腺がんの治療など、広く活用されています。
補足2)Figure 1のホウ素クラスターの構造を見ると、11個のホウ素と1つの炭素からなるカルボラン [B11CH12] と勘違いされる方がいます。しかし、カルボランは水溶性に乏しいため、そのままでは、ホウ素薬剤への適応が難しいという課題があります。一方、12個のホウ素と12個の水素からなる[B12H12]2–は水溶性を示しますが、[B12H12]2–を母体骨格とするホウ素クラスターの素反応は有機化学の反応が多様性に富んでいること比較すると少ないのが現状です。これは、カルボラン [B11CH12]はクラスター上に炭素原子を含むため、有機化学が最も得意とする炭素上の官能基変換が用いれるが、[B12H12]2–を母体骨格とするホウ素クラスターは、ホウ素原子の化学修飾を施す必要があるため、用いることのできる素反応が炭素原子上の化学修飾に比べ圧倒的に少ないということが原因であると考えられます。